近日,来自澳大利亚彼得·麦卡伦癌症中心的Mark A. Dawson团队在Nature上在线发表题为 Non-genetic determinants of malignant clonal fitness at single-cell resolution 的文章,利用单细胞分析和谱系追踪(SPLINTR)在三个临床相关的急性髓系白血病小鼠模型中追踪等基因克隆,发现恶性克隆优势是一种细胞固有的可遗传特性,可通过抑制抗原递呈和增加分泌性白细胞肽酶抑制剂基因(Slpi)的表达来促进。而增加的转录异质性作为一种特征,可以使克隆适应于不同的组织和免疫微环境、以及在遗传上不同的克隆之间进行的克隆竞争。由此对构成恶性克隆适应性的基础的非遗传转录过程提供了基本见解,并为未来的治疗策略提供了可供参考的重要信息。

急性白血病是由涉及混合谱系白血病 (KMT2A,也称为MLL1) 基因易位的致癌融合所驱动的,这就使得其成为人类癌症中的罕见例子——单基因异常是导致此侵略性致命恶性肿瘤的必要充分条件。可以想见,这种突变惰性和遗传稳定的癌症是研究导致克隆优势的非遗传机制的理想模型。为了评估转录程序对未来细胞命运的影响,本文研究人员开发了一种称为SPLINTR的表达条形码策略,构建了三个高度多样性文库,每个文库都具有不同的条形码结构,并与不同的荧光染料相耦合。同时SPLINTR条形码可以通过3′单细胞RNA测序(scRNA-seq)方法轻松捕获,并且可以以与匹配的DNA条形码测序相当的频率进行识别。由于这些条形码主要以单个细胞拷贝的形式存在,因此它们能够以时间分辨的方式准确描述克隆命运和基因表达。
研究人员首先用MLL-AF9癌基因(KMT2A和MLL T3的融合)转化小鼠的造血干细胞(HSC)和粒细胞-单核细胞祖细胞(GMP),然后用不同的SPLINTR文库标记它们,经克隆扩增后移植至小鼠,结果发现两种细胞来源的克隆在所有小鼠中都会引起疾病,表明克隆适合性是一种细胞固有特性,而与来源细胞无关。与此同时,用MLL-AF9癌基因转化异质混合的HSC和造血祖细胞(HPC)以模拟MLL白血病,也能在多只小鼠中观察到相同的白血病起始克隆。值得注意的是,在小鼠中占主导地位的白血病起始克隆不一定是移植前在体外扩张最快的克隆,这表明在体内赋予克隆适应性的特性超出了增殖潜力,并且与在体外赋予适应性的特性不同。利用SPLINTR在移植前立即检测出现在白血病起始克隆中的转录程序发现,起源细胞和白血病干细胞(LSC)特征并没有必然联系,细胞固有的克隆适应性不能简单地归因于一个统一的转录状态。
为了了解不同的二级突变如何影响克隆适应性,研究人员从野生型或同基因C57BL/6小鼠中产生了三种遗传上不同的MLL-AF9白血病,其中两种存在着Flt3(Flt3ITD)或Kras(KrasG12D)的内源性敲入激活突变。为了检测这些不同AML基因型的特性,每一株细胞系都用独特的SPLINTR条形码文库进行条形码编码,并分别移植到小鼠体内(图1)。分析数据表明无论致癌基因型如何,克隆优势是引发疾病的克隆的细胞固有特性。在移植前立即对致病克隆祖先的转录组进行评估发现,三种基因型的优势克隆均表现出免疫相关基因信号特征的显著下调,特别是通过主要组织相容性复合体I类的抗原处理和递呈途径,而且这些转录特征也出现在体内暴发性疾病发生时,表明转录程序的可遗传繁殖在所有基因型中都具有固有的克隆优势。随后,研究人员将三种基因型MLL-AF9细胞以相同比例或倾斜比例(更准确地反映了临床上发现的恶性亚克隆结构)移植到小鼠身上,以期在遗传多样性克隆之间的克隆竞争的背景下研究这些克隆优势原则。结果显示竞争特异性和等基因致病克隆的转录大致聚集在一个相似的位置,但前者表现出更大的转录异质性,这一特征与环境压力背景下的适应潜力有关。从scRNA-seq数据分析发现在竞争特异性克隆中,与染色质重塑和mRNA加工相关的表达基因的转录爆发动力学存在显著差异。研究结果表明,内在的克隆优势受遗传多样性克隆之间竞争的影响,在这种情况下,转录异质性可能促进恶性克隆的适应性。为了研究不同的免疫和组织微环境对克隆优势的作用,研究人员将相同的SPLINTR条码白血病细胞移植到免疫缺陷小鼠 (NSG) 或免疫活性小鼠 (Ptprca) 体内。实验结果显示白血病起始克隆共享所有转录聚集在一起的微环境,并且表现出优势克隆的特征,包括丰富的LSC程序和Slpi的过表达。
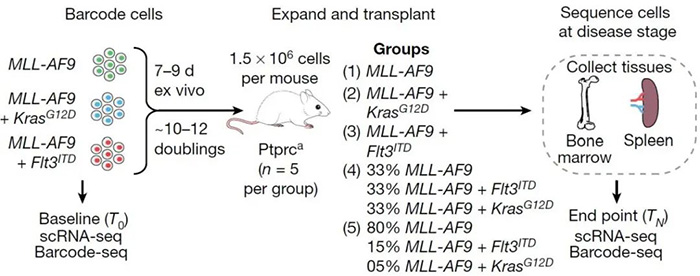
图1
本研究中的所有体内实验均确定了癌症起始克隆中富集的预先存在的细胞固有转录状态,为了检验这些转录状态是否可遗传,研究人员从患病小鼠的骨髓和脾脏中分离出SPLINTR GFP标记的MLL-AF9 KrasG12D细胞,并用不同的SPLINTR文库对这些细胞重新编码,然后按同等比例混合再次移植到NSG或Ptprca小鼠体内(图2)。实验结果发现,癌症起始细胞固有的转录/表观遗传特征在癌症起源细胞的原生微环境中保存得最好,同时证实了克隆适应性特征的非遗传性遗传——尽管在体外和体内暴露于不同的微环境中,一些细胞仍能稳定地遗传癌症起始和生长所必需的转录状态。
与此同时,研究人员发现LSC克隆也可分为高、中或低产量,并且这种细胞内在行为在不同受体小鼠中高度一致。利用顺序组合SPLINTR条形码策略(图2)追踪克隆行为,研究人员发现高产量克隆在随后的移植中保持了这一特性,而低产量和中等产量克隆从未过渡到高产量克隆。进一步地对患病小鼠进行类似于人类AML治疗的强化化疗,并收集一系列微小残留病(MRD)样本,对相同克隆群体在有/无治疗压力下的情况进行了详细的时间分析,结果显示了三种主要模式:(1)高/中产量克隆,其克隆产量仅因治疗而短暂减少;(2)改变克隆行为以采用低产量状态的高/中产量克隆;(3)仅在治疗情况下,低产量克隆才会转变为高产量状态,从而导致治疗后绝大多数MRD负担。由此表明LSC克隆产量决定了对化疗的敏感性,尽管高产量和低产量克隆对治疗压力的适应不同,但它们随着LSC程序表达的增加而协同出现在MRD中。
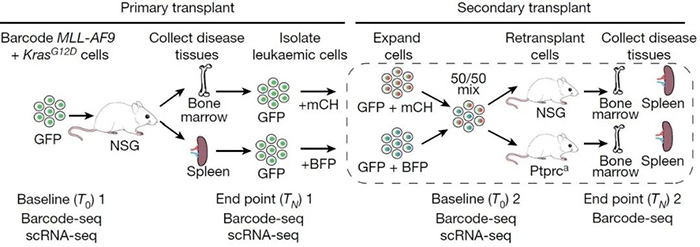
图2
综上所述,本研究使用SPLINTR以一种时间解析的方式同时跟踪数千个恶性克隆,以确定超出癌症基因组的克隆适应性的原则。证实了无论起源于何种细胞,克隆优势是一种细胞固有的可遗传的状态,不能归因于统一的转录程序,相反,转录多样性的增加是克隆适应性的一个一致特征,尤其是在更具挑战性的微环境中。同时还证实了癌症干细胞在整个肿瘤负担中所起的作用并不相同,恶性克隆产量是细胞固有的和可遗传的特性,它决定了适应性过程和对化疗的敏感性。由此强调了迫切需要解决遗传和非遗传异质性问题,同时强调了实现人们在个性化癌症医学方面的雄心壮志。
原文链接:
https://doi.org/10.1038/s41586-021-04206-7













